Tofacitinib citrate adalah obat resep (nama dagang Xeljanz) yang awalnya dikembangkan oleh Pfizer untuk kelas penghambat oral Janus kinase (JAK). Ini secara selektif dapat menghambat JAK kinase, memblokir jalur JAK/STAT, dan dengan demikian menghambat transduksi sinyal sel serta ekspresi dan aktivasi gen terkait, digunakan untuk mengobati rheumatoid arthritis, arthritis psoriatis, kolitis ulseratif dan penyakit kekebalan lainnya.
Obat ini mencakup tiga bentuk sediaan: tablet, tablet lepas lambat, dan larutan oral. Tabletnya pertama kali disetujui oleh FDA pada tahun 2012, dan bentuk sediaan lepas lambat disetujui oleh FDA pada bulan Februari 2016. Ini adalah yang pertama untuk mengobati sendi reumatoid. Yan adalah penghambat JAK yang diminum sekali sehari. Pada bulan Desember 2019, indikasi baru untuk obat pelepasan berkelanjutan disetujui lagi untuk kolitis ulserativa (UC) aktif sedang hingga berat. Selain itu, uji klinis fase 3 saat ini untuk psoriasis plak telah selesai, dan enam uji klinis fase 3 lainnya sedang berlangsung, yang melibatkan artritis psoriatik aktif, artritis idiopatik remaja, dll. Jenis indikasi. Keunggulan tablet lepas lambat yang bersifat jangka panjang dan hanya perlu diminum sekali sehari sangat membantu dalam penatalaksanaan dan pengendalian penyakit pasien.
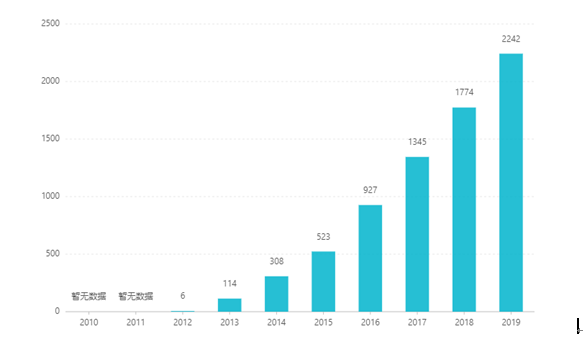
Sejak pencatatannya, penjualannya meningkat dari tahun ke tahun, mencapai US$2,242 miliar pada tahun 2019. Di Tiongkok, bentuk sediaan tablet disetujui untuk dipasarkan pada bulan Maret 2017, dan masuk dalam katalog asuransi kesehatan kategori B melalui negosiasi pada tahun 2019. Pemenang terbaru tawarannya adalah RMB 26,79. Namun, karena tingginya hambatan teknis dalam sediaan pelepasan berkelanjutan, bentuk sediaan ini belum dipasarkan di Tiongkok.
JAK kinase berperan penting dalam peradangan, dan penghambatnya telah terbukti mengobati penyakit inflamasi dan autoimun tertentu. Hingga saat ini, 7 inhibitor JAK telah disetujui secara global, termasuk Delgocitinib dari Leo Pharma, Fedratinib dari Celgene, upatinib dari AbbVie, Pefitinib dari Astellas, Baritinib dari Eli Lilly, dan Rocotinib dari Novartis. Namun, hanya tofacitinib, baritinib, dan rocotinib yang disetujui di Tiongkok di antara obat-obatan yang disebutkan di atas. Kami menantikan “Tablet Pelepasan Berkelanjutan Tofatib Sitrat” Qilu disetujui sesegera mungkin dan memberikan manfaat bagi lebih banyak pasien.
Di Tiongkok, penelitian asli tofacitib citrate telah disetujui oleh NMPA pada bulan Maret 2017 untuk pengobatan pasien RA dewasa dengan kemanjuran yang tidak mencukupi atau intoleransi terhadap metotreksat, dengan nama dagang Shangjie. Menurut data Meinenet, penjualan tablet tofacitib sitrat di institusi medis publik Tiongkok pada tahun 2018 berjumlah 8,34 juta yuan, jauh lebih rendah dibandingkan penjualan global. Alasan terbesarnya adalah harga. Dilaporkan bahwa harga eceran awal Shangjie adalah 2.085 yuan (5mg*28 tablet), dan biaya bulanannya adalah 4.170 yuan, yang bukan merupakan beban kecil bagi keluarga biasa.
Namun, patut dirayakan bahwa tofacitib dimasukkan dalam “Daftar Obat Asuransi Kesehatan Dasar Nasional, Asuransi Kecelakaan Kerja, dan Asuransi Bersalin” tahun 2019 oleh Administrasi Asuransi Kesehatan Nasional setelah negosiasi pada bulan November 2019. Dilaporkan bahwa biaya bulanan akan dikurangi menjadi di bawah 2.000 yuan setelah pemotongan harga dinegosiasikan, yang akan sangat meningkatkan ketersediaan obat tersebut.
Pada bulan Agustus 2018, Badan Pemeriksaan Ulang Paten Kantor Kekayaan Intelektual Negara mengambil keputusan peninjauan kembali permohonan pembatalan No. 36902, dan menyatakan tidak sahnya paten inti Pfizertofatib, paten majemuk, dengan alasan tidak cukupnya pengungkapan spesifikasi. Namun paten bentuk kristal Pfizertofatiib (ZL02823587.8, CN1325498C, tanggal permohonan 25/11/2002) akan habis masa berlakunya pada tahun 2022.
Basis data Insight menunjukkan bahwa, selain penelitian asli, lima obat generik Chia Tai Tianqing, Qilu, Kelun, Sungai Yangtze, dan Nanjing Chia Tai Tianqing telah disetujui untuk dipasarkan dalam formulasi tablet tofacitinib dalam negeri. Namun, untuk jenis tablet lepas lambat, hanya penelitian asli Pfizer yang mengajukan permohonan pemasaran pada 26 Mei. Qilu menjadi perusahaan dalam negeri pertama yang mengajukan permohonan pemasaran formulasi ini. Selain itu, CSPC Ouyi sedang dalam tahap uji coba BE.
Pabrik Farmasi Changzhou (CPF) adalah produsen API farmasi terkemuka, formulasi jadi di Tiongkok, yang berlokasi di Changzhou, provinsi Jiangsu. CPF didirikan pada tahun 1949. Kami telah mengabdikan diri pada Tofacitinib Sitrat mulai tahun 2013, dan sudah mengirimkan DMF. Kami telah mendaftar di banyak negara, dan dapat mendukung Anda dengan dukungan dokumen terbaik untuk Tofacitinib Citrate.
Waktu posting: 23 Juli-2021